La rapidez con la que ocurre una reacción química depende de varios factores:
1. Concentración de reactivos
2. Temperatura
3. Superficie de contacto y
4. Catalizadores
1. Cuando incrementamos la concentración de reactivos en una reacción se observa con facilidad que las reacciones son aceleradas. A mayor concentración mayor número de partículas (moléculas, iones o átomos) por unidad de volumen, hay por lo tanto mas colisiones y mas eventos de reacción.
2. Al incrementar la temperatura la rapidez de las reacciones también es acelerada esto se debe a que el movimiento de las partículas se incrementa con la temperatura. Por lo tanto, a temperaturas altas las colisiones promedio son más enérgicas, aumentando la probabilidad de rompimiento de enlaces; dando lugar al reordenamiento atómico para el desarrollo de la reacción. 3. Si aumentamos la superficie de contacto, aumentamos la rapidez de reacción, ya que tenemos más lugares por donde se lleven acabo mas choques efectivos.
 El zinc en polvo reacciona más rápidamente que la granalla con el ácido clorhídrico para liberar hidrógeno gas.
El zinc en polvo reacciona más rápidamente que la granalla con el ácido clorhídrico para liberar hidrógeno gas.
4. Los catalizadores son sustancias que pueden acelerar o retardar (inhibidores) el curso de una reacción, sin que sean partícipes de ella, es decir, su naturaleza no cambia durante el proceso químico. Los catalizadores modifican la Ea de una reacción determinada. Si el propósito es acelerar la reacción, el catalizador hace que la Ea sea menor (fig. 3); pero si lo que se quiere es retardarla, se utiliza un inhibidor, éste aumentará la Ea.
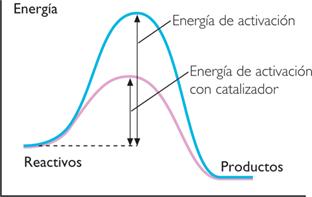
Figura 3 Diagrama de energía en una reacción exotérmica. Con catalizadores, la energía de activación disminuye para iniciar más rápiodo el proceso.
(Tomada de www.kalipedia.com/fisica-quimica/tema/energia...)
La presencia de un catalizador disminuye la energía de activación, pero no cambia la energía de los reactivos (inicial) ni la de los productos (finales).
Anterior Subtema 2.1

 El zinc en polvo reacciona más rápidamente que la granalla con el ácido clorhídrico para liberar hidrógeno gas.
El zinc en polvo reacciona más rápidamente que la granalla con el ácido clorhídrico para liberar hidrógeno gas.