El curso energético de una reacción puede ser representado por medio de una gráfica, cuyos ejes son energía y tiempo. Está gráfica es el “perfil de energía” en una reacción química, y en él puede, también, representarse la energía de activación (Ea). La Ea es la diferencia de valores entre la energía de los reactivos y la máxima energía (la parte mas alta del diagrama) que se requiere para que los átomos de las moléculas sean reordenados, es decir, el estado de transición donde se forma el complejo activado; en este estado los enlaces entre los átomos de las moléculas de los reactivos se rompen para formar nuevos enlaces, se forman nuevas moléculas y entonces aparecen los productos. Recuerda que para romper enlaces, el sistema debe absorbe energía, y cuando se forman nuevos enlaces se libera energía.
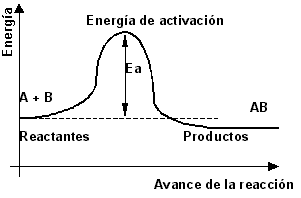
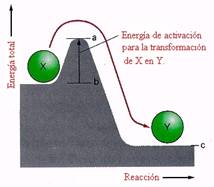
Figura 2. Diagramas equivalentes de energía vs. tiempo. Se añade energía a la reacción (energía de activación) para iniciar el proceso.
(Tomada de: www.deciencias.net/.../reacciones/energia.htm) y
(www.fisicanet.com.ar/quimica/cinetica_quimica...)
 Actividad
Actividad
Ve la siguiente presentación y comenta con tu asesor lo que entendiste de lo sucedido en una reacción, si comprendes la explicación en inglés activa el volumen de tu computadora, si no espera a que se muestren los botones para seguir los pasos de la evolución de una reacción exotérmica y endotérmica.
http://www.mhhe.com/physsci/chemistry/essentialchemistry/flash/activa2.swf
(Tomada para fines didácticos de Aula Física y Química)
Anterior Subtema 2.1 Siguiente



