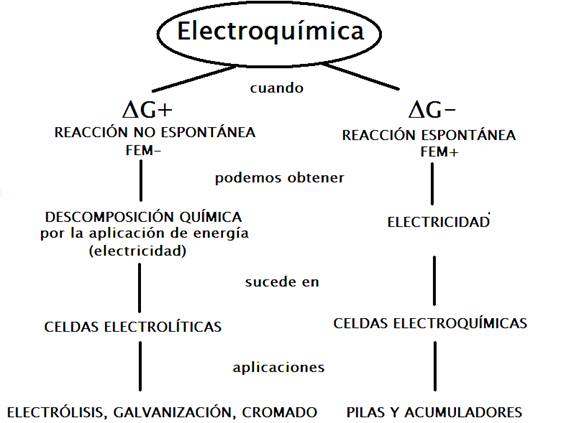
La electroquímica es la rama de la química que estudia y analiza la interconversión de la energía química y la energía eléctrica y viceversa.
Todos los procesos electroquímicos son procesos de oxidación reducción, en donde la energía liberada por una reacción química espontánea es transformada en energía eléctrica, o bien donde la energía eléctrica es usada para que una reacción química no espontánea, se lleve a cabo. La siguiente figura ilustra como se relaciona la energía química y eléctrica en los procesos electroquímicos.
Para comprender estos procesos se necesita entender, que sucede cuando los electrodos interactúan con el electrolito.
Un electrolito es una sustancia que en disolución acuosa conduce la energía eléctrica, porque al disociarse en iones positivos y negativos pueden conducir la energía eléctrica. Las sales, las bases y algunos ácidos tienen esta propiedad y dependiendo del grado de disociación, se clasifican en electrolitos fuertes o débiles.
 Actividad
Actividad
Ve a la página (Tomada para uso didáctico)
http://www.educaplus.org/index.php?option=com_content&task=view&id=144&Itemid=1 para que puedas observar la ionización de algunas sustancias en medio acuoso y puedas clasificarlas en electrolitos fuertes, débiles o no electrolitos.
Si se coloca una barra de zinc metálico (Zn),en una disolución diluida de ZnSO4 (electrolito), el zinc metálico tiene tendencia a perder electrones y pasar a la disolución como iones Zn2+, al mismo tiempo estos iones en disolución, al acercarse a la barra, ganan electrones y se reducen a Zn metálico. Este proceso ocurre continuamente hasta alcanzar un equilibrio
Zn0 → Zn2+ + 2e-
Por el contrario, si se introduce una barra de cobre (Cu) en una disolución de CuSO4, los iones Cu2+ de la disolución tienen tendencia a ganar electrones al acercarse a la barra de cobre y pasan a Cu metálico, mientras que el cobre metálico pierde electrones y pasa a la disolución como Cu2+ hasta alcanzar el equilibrio
Cu2+ + 2e- → Cu0
Si estos dos sistemas interactúan en un recipiente, separados por una membrana porosa, para evitar que se mezclen y las barras metálicas se conectan a un multímetro por medio de un alambre de cobre, se obtiene una celda electroquímica (celda voltaica). También, se logra una celda de este tipo dejando los sistemas en recipientes separados y para lograr el contacto de ambas disoluciones se coloca un puente salino.
Un puente salino, es un tubo en forma de “U” que se llena con un electrolito que no reaccione con los iones de la celda ni con los electrodos; se taponan los extremos con algodón para evitar que salga y se invierte sobre los recipientes, teniendo cuidado de que los extremos queden sumergidos en las disoluciones de los dos electrolitos, lo que permitirá neutralizar eléctricamente a la celda.
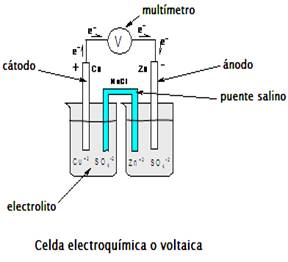
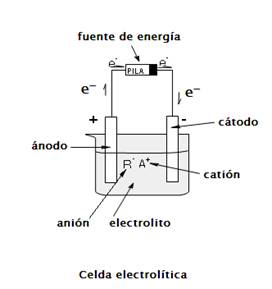
Los electrones siempre se desplazan de un estado de energía potencial más alto a uno más bajo, la diferencia de energía entre estos dos estados se llama fuerza electromotriz (FEM) o diferencia de potencial.
En los electrodos, la oxidación y reducción suceden simultáneamente, al llevarse a cabo el intercambio de electrones de los aniones a los cationes. Este proceso se puede medir por medio de un multímetro.
El electrodo que atrae a los iones negativos se le denomina ánodo y es positivo, donde ocurre la oxidación y al electrodo negativo que atrae a los iones positivos se le conoce como cátodo en donde se lleva a cabo la reducción.
Nota: En el ánodo se lleva a cabo la oxidación y en el cátodo la reducción.
 Actividad
Actividad
Para que se pueda comprender mejor este proceso, observa lo que sucede en una celda electroquímica en la presentación que encontrarás en:
http://www.mhhe.com/physsci/chemistry/essentialchemistry/flash/galvan5.swf
(Tomada para fines didácticos de Aula de Física y Química)
Las reacciones que suceden en cada electrodo se llaman semirreacciones y para representarlas en forma condensada primero se escribe la semirreación de oxidación separando a las dos especies con una línea vertical, después la semirreacción de reducción, separadas las especies de la misma manera por una línea vertical y por último se separan las dos semirreaciones con dos líneas verticales.
Por lo tanto la celda se representa como sigue:
Zn0 | Zn2+ semirreacción de oxidación
Cu2+ | Cu0 semirreacción de reducción
Zn0 | Zn2+ || Cu2+ | Cu0 celda completa
Anterior Subtema 1.2 Siguiente





