Hay dos procesos diferentes de gran importancia en electroquímica:
- Aprovechar las reacciones espontáneas de óxido reducción para producir una corriente de energía eléctrica, como en el caso de las pilas voltaicas y galvánicas; esta energía se emplea para poner en marcha a los automóviles, hacer funcionar radios de transistores, calculadoras, relojes, e incluso suministrar energía para una nave espacial.
- Producir una reacción de óxido reducción que no podría ocurrir espontáneamente y que se utiliza para realizar transformaciones químicas como las celdas electrolíticas que requieren de una fuente de energía para llevarse a cabo, por ejemplo la electrólisis del agua, la producción del aluminio, y el refinamiento de algunos metales.
La oxidación se refiere a:
- La ganancia de oxígeno por parte de una molécula
- La pérdida de hidrógeno en una molécula
- La pérdida de electrones que sufre un átomo o grupo de átomos
- Aumentando en consecuencia su número de oxidación
La reducción se refiere a:
- La pérdida de oxígeno por parte de una molécula
- La ganancia de hidrógeno en una molécula
- La ganancia de electrones que sufre un átomo o grupo de átomos
- Disminución o reducción en su número de oxidación
Los procesos de oxidación y reducción suceden simultáneamente y nunca de manera aislada, por lo que se denominan reacciones redox.
Para balancear este tipo de reacciones estudiaremos dos métodos:
- Método redox o cambio del número de oxidación.
- Método de ion electrón.
 En el método REDOX se realizan los siguientes pasos:
En el método REDOX se realizan los siguientes pasos:
Paso 1. Asignar el número de oxidación de todos los elementos presentes en la reacción y reconocer los elementos que se oxidan y reducen.
Nota: Todo elemento libre tiene número de oxidación cero.
- Por ejemplo: Cu 0 + H1+N5+ O
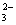 → Cu2+(N5+O
→ Cu2+(N5+O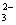 )2 + H
)2 + H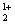 O2- + N2+O2-
O2- + N2+O2-
Paso 2. Escribir las semirreacciones de oxidación y reducción con los electrones de intercambio.
Cu 0 → Cu2+ + 2e- semirreacción de oxidación
N5+ + 3e- → N2+ semirreacción de reducción
Paso 3. Balancear el número de átomos en ambos lados de las semirreacciones. En este caso están balanceados:
Cu 0 → Cu2+ + 2e-
N5+ + 3e- → N2+
Paso 4. Igualar el número de electrones ganados y cedidos:
3[Cu0 → Cu2+ + 2e-]
2[N5+ + 3e- → N2+]
3Cu0 → 3Cu2+ + 6e-]
2N5+ + 6e- → 2N2+
Nota: El número de electrones ganados debe ser igual al número de electrones cedidos.
Paso 4. Colocar los coeficientes encontrados en la ecuación original donde se verificó el cambio del número de oxidación:
Cu 0 + HNO3 → 3Cu(NO3)2 + H2O + 2NO
Paso 5. Completar el balanceo ajustando el número de átomos en ambos lados de la reacción:
3Cu0 + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO
 Balancear por el método redox las siguientes reacciones:
Balancear por el método redox las siguientes reacciones:
a) Fe2O3 + CO → CO2 + Fe
b) HNO3 + Sn0 → SnO2 + NO + H2O
c) Na2S2O3 + H2O2 → Na2SO4 + H2SO4 + H2O
d) FeS2 + O2 → Fe2O3 + SO2
e) NH3 + Cu0 → N2 + Cu + H2O
Respuesta:
a) Fe2O3 + 3CO → 3CO2 + 2Fe
b) 2HNO3 + 3SnO → 3SnO2 + 2NO + H2O
c) Na2S2O3 + 4 H2O2 → Na2SO4 + H2SO4 + 3H2O
d) 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
e) 2NH3 + 3Cu0 → N2 + 3Cu + 3H2O

I. Reacciones que ocurren en medio ácido.
 Balancear la reacción química siguiente:
Balancear la reacción química siguiente:
CaC2O4 + KMnO4 + H2SO4 → CaSO4 + MnSO4 + K2SO4 + CO2 + H2O
Paso 1. Los compuestos iónicos se separan en sus iones componentes, señalando con toda claridad sus cargas correspondientes. Los óxidos y los compuestos covalentes no se separan en iones.
Ca2+ + (C204)2- + K1+ + (MnO)1- + H+ + (SO4)2- → Ca2+ + (SO4)2- + Mn2+ + (SO4)2- +
K1+ + (SO4)2- + CO2 + H2O
Paso 2. Se simplifica la reacción eliminando de ella todas aquellas especies químicas que no tienen cambios durante el proceso.


Las especies que permanecen después de esta simplificación son las que toman parte en el proceso redox. El resultado de este proceso recibe el nombre de reacción iónica. En ésta, puede advertirse que aparece el ion H1+, lo que indica que el proceso redox ocurre en medio ácido.
(C204)2- + (MnO4)1- + H1+ → Mn2+ + SO42- + CO2 + H2O
Paso 3. Se escriben las semirreacciones de oxidación y de reducción en cualquier orden:
(C204)2- → CO2 semirreacción de oxidación
(MnO4)1- → Mn2+ semirreacción de reducción
Paso 4. Balance de masa:
a. Primero se balancean todos los átomos de los elementos, que no sean oxígeno e hidrógeno.
Hay dos átomos de carbono en el primer miembro de la primera semirreacción y sólo uno en el segundo miembro. Esto se ajusta mediante el coeficiente adecuado.
(C204)2+ → 2CO2
La segunda semirreacción queda igual. Sólo hay un átomo de manganeso en ambos miembros.
(MnO4)1- → Mn2+
b. Ahora se balancea el oxígeno. En medio ácido, el exceso de oxígeno se balancea con agua en el miembro contrario de la semirreacción.
En la primera semirreacción el oxígeno está balanceado, no así en la segunda. En ésta hay 4 átomos de oxígeno en el ion (MnO4)1- y por tanto, se balancea con agua como se indicó:
(MnO4)1- → Mn2+ + 4H2O
Por último se balancea el hidrógeno con iones H+ en el lado contrario:
8H++ (MnO4)1- → Mn2+ + 4H2O
Con esto concluye el proceso de balance de masa. El resultado es:
(C204)2+ → 2CO2
8H++ (MnO4)1- → Mn2+ + 4H2O
Paso 5. Balance de carga. Este paso sólo debe realizarse después del balance de masa. Nunca antes.

Paso 6. Balance del número de electrones perdidos y ganados. El número de electrones perdidos y ganados debe ser el mismo en todo proceso redox. Esto se logra multiplicando por el factor adecuado las semirreacciones redox balanceadas en masa y carga:
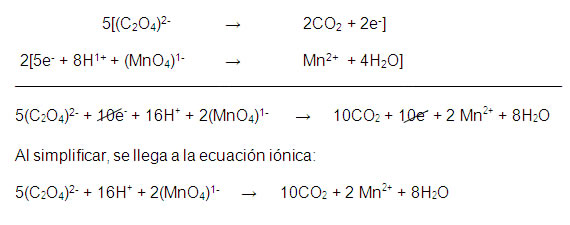
Paso 7. Los coeficientes que se obtienen en la ecuación iónica se trasladan a la reacción general, pero sólo quedarán balanceadas las especies que intervinieron en el proceso redox:
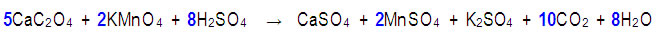
Paso 8. Por último se ajustan las especies que permanecieron sin cambios en el proceso redox:
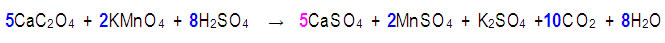
II. Reacciones que ocurren en medio básico.
 Balancear la reacción química siguiente:
Balancear la reacción química siguiente:
Zn + NaNO3 + NaOH → Na2ZnO2 + NH3 + H2O
Paso 1. Los compuestos iónicos se separan en sus iones componentes, señalando con toda claridad sus cargas correspondientes. Los óxidos y los compuestos covalentes no se separan en iones. Los elementos libres tienen carga cero.
Zn0 + Na1+ + (NO3)1- + Na1+ + (OH)1- → Na+ + (ZnO2)2- + NH3 + H2O
Paso 2. Se simplifica la reacción eliminando de ella todas aquellas especies químicas que no tienen cambios durante el proceso.
Zn0 + Na+ + (NO3)1- + Na+ + (OH)1- → Na+ + (ZnO2)2- + NH3 + H2O
Las especies que permanecen son las que toman parte en el proceso redox. El resultado de este proceso recibe el nombre de reacción iónica. En ésta, puede advertirse que aparece el ion (OH)1-, lo que indica que el proceso ocurre en medio básico.
Zn0 + (NO3)1- + (OH)1- → (ZnO2)2- + NH3 + H2O
Paso 3. Se escriben las semirreacciones de oxidación y de reducción en cualquier orden:
Zn0 → (ZnO2)2-
(NO3)1- → [NH3]0
Paso 4. Balance de masa:
Balancear átomos diferentes de oxígeno e hidrógeno. En ambas semirreacciones están balanceados.
Balancear los átomos de oxígeno con moléculas de agua. Se cuentan los átomos de oxígeno y se agregan, en igual número, moléculas de agua del otro lado de la reacción o reacciones:
2H2O + Zn0 → (ZnO2)2-
(NO3)1- → [NH3]0 + 3H2O
Los átomos de hidrógeno por facilidad, se ajustan con iones H+ como si fuera una reacción que se verifica en medio ácido:
2H2O + Zn0 → (ZnO2)2- + 4H+
9H+ + (NO3)1- → [NH3]0 + 3H2O
Para compensar los iones H+, se adicionan igual número de iones (OH)- en ambos lados de las semirreacciones y formar moléculas de agua, los iones (OH)- sobrantes, corresponden al medio básico de la reacción:
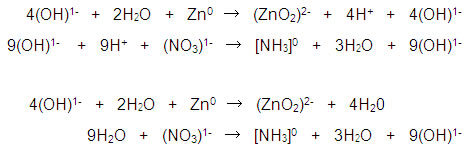
Paso 5. Balance de carga. Este paso sólo debe realizarse después del balance de masa. Nunca antes.
Se agregan electrones (e-) para igualar las cargas iónicas:
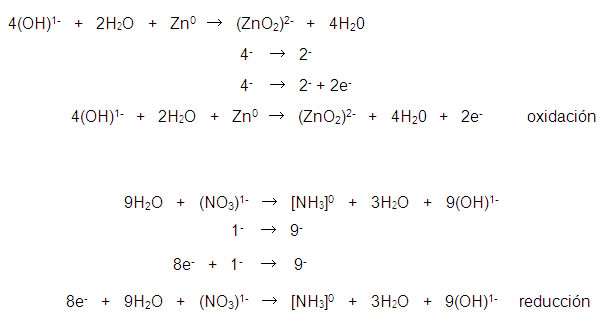

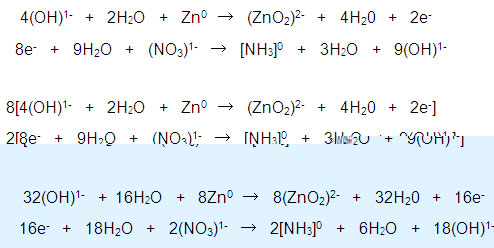
Al sumar y simplificar las semirreacciones:
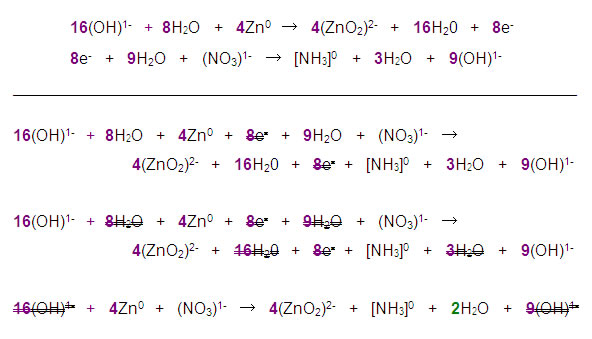
Ecuación iónica completa:
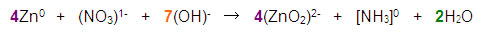
Paso 7. Los coeficientes que se obtienen en la ecuación iónica se trasladan a la reacción general, pero sólo quedarán balanceadas las especies que intervinieron en el proceso redox:
4Zn + NaNO3 + 7NaOH → 4Na2ZnO2 + NH3 + 2H2O
Paso 8. Por último se ajustan las especies que permanecieron sin cambios en el proceso redox:
4Zn + NaNO3 + 7NaOH → 4Na2ZnO2 + NH3 + 2H2O
 Actividad
Actividad
Investiga cómo se puede identificar al agente oxidante y agente reductor en una reacción de redox.
 Balancea por el método de ion electrón las siguientes reacciones químicas. Entrégalas a tu asesor de forma escrita para la revisión de los pasos que seguiste, incluye la identificación del agente oxidante y reductor:
Balancea por el método de ion electrón las siguientes reacciones químicas. Entrégalas a tu asesor de forma escrita para la revisión de los pasos que seguiste, incluye la identificación del agente oxidante y reductor:
a) Bi2O3 + KOH + KClO → KBiO3 + KCl + H2O
b) Cl2 + KOH → KClO3 + KCl + H2O
c) C + HNO3 → CO2 + NO2 + H2O
Anterior Subtema 1.2 Siguiente






