En la naturaleza todos los procesos que se realizan, son procesos que tienden a adquirir estados energéticos más estables, esto es, conseguir disminuir la energía contenida del sistema. Esta situación se logra, al desprender parte de la energía y emplearla para realizar trabajo útil.
De acuerdo con la primera ley de la termodinámica, la energía total del universo se conserva. Es decir, en todo proceso natural, la energía se conserva pero dicha energía tiende a dispersarse y se vuelve menos aprovechable. (La energía se conserva en cantidad pero no en calidad).
Uno de los principales objetivos de la termodinámica es predecir si un proceso ocurrirá o no de manera espontánea en ciertas condiciones. En los laboratorios y en la industria es de gran utilidad conocer los factores que influyen en la espontaneidad de las reacciones y valorar su viabilidad y también es útil para entender los complicados procesos biológicos.
A una reacción que ocurre en ciertas condiciones se le llama reacción espontánea y si no se verifica en esas condiciones es una reacción no espontánea. Cabe aclarar, que si un proceso se lleva a cabo en ciertas condiciones no necesariamente ocurre en dirección opuesta bajo las mismas condiciones.
Un proceso es reversible, cuando el cambio que sufre el sistema se efectúa de tal forma que se puede devolver a su estado original, sin que haya cambio neto en el sistema ni en el entorno. Un proceso es irreversible es aquel en el que no se puede devolver el sistema y el entorno a su estado original.
De estas situaciones, se derivan dos conceptos importantes:
Siempre que un sistema químico está en equilibrio, los reactivos y productos se interconvierten reversiblemente.
En todo proceso espontáneo, el camino que va de reactivos a productos es irreversible.
 Muchos procesos físicos y químicos ocurren de forma espontánea en la naturaleza:
Muchos procesos físicos y químicos ocurren de forma espontánea en la naturaleza:
-
El agua de una cascada cae pero nunca sube espontáneamente.
-
Al dejar caer un huevo se rompe y no se une espontáneamente.
-
El hielo se funde a temperatura ambiente y no se congela espontáneamente.
-
El sodio reacciona con el agua para formar hidróxido de sodio e hidrógeno y nunca el hidrógeno reacciona con el hidróxido espontáneamente para formar sodio y agua.
-
El calor fluye de un sistema de mayor temperatura a uno de menor y no espontáneamente al contrario.
Se ha observado que numerosos procesos exotérmicos son espontáneos, pero también que algunos no lo son y que procesos endotérmicos son espontáneos. Esto nos indica que existe otro factor que influye sobre la espontaneidad y es la entropía, S.
-
De aquí se desprende la Segunda Ley de la Termodinámica: (existen diversas maneras de expresarla)
-
Los procesos naturales ocurren sólo en una dirección, la de la máxima dispersión de energía.
-
La entropía del universo aumenta en el curso de todo proceso natural.
-
Clausius: Todo proceso cíclico cuyo único efecto final sobre los alrededores sea transferir calor de un cuerpo frío a un cuerpo caliente, es imposible.
-
Kelvin-Planck: Todo proceso cíclico cuyo único efecto final sobre los alrededores sea absorber calor de un cuerpo y convertirlo íntegramente en trabajo, es imposible.
Para entender la entropía, se analizará que sucede a nivel microscópico en un sistema determinado.
En un sólido, las partículas están juntas en una posición fija, sólo existen movimientos de vibración. En un líquido se encuentran más separadas y en un gas aún más. Cuando aumenta la temperatura del gas, la energía cinética de las partículas es mayor y la separación entre ellas se incrementa. Esto nos muestra que cuando la cantidad de energía de un sistema aumenta, la entropía también lo hace debido a la dispersión de la materia o desorden en el sistema.
S sólido< S líquido < S gas < S gas a mayor temperatura
La entropía por lo tanto puede definirse como el grado de dispersión de la energía
o el grado de desorden de la materia en un sistema. La entropía no puede decrecer naturalmente, por lo tanto, un sistema que la disminuya será sumamente improbable.
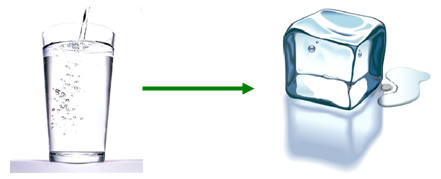
 El agua líquida a temperatura ambiente y a presión atmosférica es imposible que se transforme en hielo.
El agua líquida a temperatura ambiente y a presión atmosférica es imposible que se transforme en hielo.
La entropía estándar de una sustancia es la entropía absoluta a 1 atmósfera de presión y 25 0C, siempre es positiva y a diferencia de las entalpías de formación para los elementos en su forma más estable, también tienen un valor. La entropía, es una función de estado y cuando un sistema cambia de un estado a otro se tiene:
∆S0 = S0f – S0i
El valor de la entropía del agua líquida es mayor que en el agua sólida, por lo tanto:
∆S0 < 0 = -
La conexión entre la entropía y la espontaneidad de un proceso queda expresada en la segunda ley de la termodinámica: la entropía del universo aumenta en un proceso espontáneo y se mantiene constante en uno en equilibrio.
Por lo que se deduce:
DS universo > O El proceso puede ocurrir, es espontáneo e irreversible.
DS universo < O El proceso es en extremo improbable, no es espontáneo.
DS universo= O El proceso es reversible, puede ocurrir en ambas direcciones.
Como podemos observar, la entropía aumenta al agregar energía térmica al sistema para cambiar de fase, de tal manera que si el cambio de calor ocurre a presión constante, estamos hablando de un cambio de entalpía. Cuando la entalpía de un sistema decrece a un valor en el que la entropía alcanza un valor mínimo, a cero grados kelvin, se toma en consideración otro principio, la tercera ley de la termodinámica que establece:
A cero grados kelvin, la entropía de un cristal perfecto es igual a cero.
El cambio de la entropía depende del cambio de la entalpía en el sistema entre la temperatura absoluta, debido a que entre menor sea ésta, mayor es el cambio en el sistema:
∆Ssistema = ∆H
T
Los valores de la entropía son pequeños, por lo que se expresan en J/K mol, para un mol de sustancia.
Para el entorno, por consiguiente se tiene:
∆Sentorno = - ∆H
T
Y para el cambio total en condiciones estándares:
∆S0 universo = ∆S0 sistema + ∆S0entorno
Para calcular el cambio de entropía de un sistema en el que ocurre una reacción química:
aA + bB → cC + dD
∆S0reacción = ∑ nS0produtos – ∑nS0reactivos
La entropía nos sirve para predecir la espontaneidad de una reacción química.
 Predecir cómo será el cambio de la entropía en condiciones estándares de las siguientes reacciones y establecer con base en éste su espontaneidad.
Predecir cómo será el cambio de la entropía en condiciones estándares de las siguientes reacciones y establecer con base en éste su espontaneidad.
a) CaCO3(s) → CaO(s) + CO2(g)
b) 2H2(g) + O2(g) → 2H2O(l)
c) H2(g) + Cl2(g) → 2HCl(g)
a) El carbonato de calcio sólido tiene un valor de entropía bajo y se descompone en óxido de calcio sólido con un menor valor de entropía por contener menor masa fórmula y en un gas que tiene mayor entropía. De estas consideraciones se deduce que el cambio de entropía en los productos es mayor con respecto a los reactivos, por tal motivo el ∆S0reacción es mayor que cero, proceso espontáneo.
Al realizar cálculos:
CaCO3(s) → CaO(s) + CO2(g)
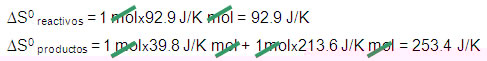
∆S0 reacción = ∆S0 productos – ∆S0 reactivos
∆S0 reacción = 253.4 J/K – 92.9 J/K = 160. 5 J/K
∆S0 reacción > 0 Proceso espontáneo
b) Dos moles de de hidrógeno gas reaccionan con un mol de oxígeno gas con un valor alto de entropía para formar dos moles de agua líquida, el sistema se ordena, hay una disminución en la entropía.
2H2(g) + O2(g) → 2H2O(l)
S0 = 131 J/K mol S0 = 39.8 J/K mol + S0 = 213.6 J/K mol
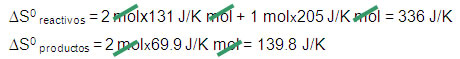
∆S0 reacción = ∆S0 productos – ∆S0 reactivos
∆S0 reacción = 139.8 J/K – 336 J/K = -196.2 J/K
∆S0 reacción < 0 Proceso no espontáneo
c) Un mol de hidrógeno gas reacciona con un mol de oxígeno gas para obtener dos moles de ácido clorhídrico gas. En este caso el valor de la entropía es positivo o negativo pero con un valor pequeño.
H2(g) + Cl2(g) → 2HCl(g)
S0 = 131 J/K mol S0 = 223 J/K mol + S0 = 187 J/K mol
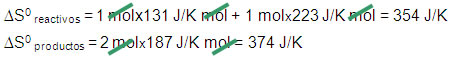
∆S0 reacción = ∆S0 productos – ∆S0 reactivos
∆S0 reacción = 374 J/K – 354 J/K = +20 J/K
∆S0 reacción < 0 Proceso no espontáneo
Como hemos visto en las reacciones anteriores, el cambio en la entropía nos muestra si un proceso es espontáneo o no en función de ella. Pero debemos considerar además el cambio de la entalpía. Un cambio en la entalpía de un sistema, transfiere energía al entorno, lo que produce un desornen en el universo, por lo que:
∆S entorno = - ∆H sistema
T
 Cuando se hace reaccionar nitrógeno gas con hidrógeno gas a temperatura ambiente, se obtiene amoniaco gas. ¿A esta temperatura la reacción es espontánea?
Cuando se hace reaccionar nitrógeno gas con hidrógeno gas a temperatura ambiente, se obtiene amoniaco gas. ¿A esta temperatura la reacción es espontánea?
N2(g) + 3H2(g) → 2NH3(g)
Nos damos cuenta que en un sistema en el que disminuye el número de moles gaseosos, el cambio de la entropía disminuye, por lo que se espera que el ∆S0r sea positivo, entonces hay que analizar el cambio de la entropía del universo:
N2(g) + 3H2(g) → 2NH3(g) ∆H0r = -92.6 kJ
S0 = 191.5 J/K mol + S0 = 131 J/K mol → S0 = 111.3 J/K mol
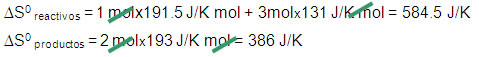
∆S0 reacción = ∆S0 productos – ∆S0 reactivos
∆S0 reacción = 386J/K – 584.5 J/K = -198.5 J/K
∆S0 reacción > 0 Proceso espontáneo
∆S0 entorno = - ( -92.6 kJ) = - 0.310 kJ = +310 J/K
298 K
∆S0 universo = ∆S0 sistema + ∆S0entorno
∆S0 universo = -198.5 J/K + 310 J/K
∆S0 universo = 111.5 J/K Reacción espontánea a 25 0C
 Predecir y calcular las entropías para las siguientes reacciones:
Predecir y calcular las entropías para las siguientes reacciones:
1. C(grafito) + O2(g) → CO2(g)
2. CS2(l) + 3O2(g) → CO2(g) + 2SO2(g)
 Actividad
Actividad
Revisa la siguiente presentación para que tengas un panorama resumido de las Leyes de la Termodinámica.
Leyes de la Termodinámica.ppt
Anterior Subtema 1.1 Siguiente






