Para determinar si un proceso es o no espontáneo, hay que tomar en consideración la variación de la entalpía y de la entropía, puesto que algunas veces se contradicen. Por un lado, la entalpía nos dice que un proceso tiende a la espontaneidad, mientras que la entropía manifiesta lo contrario. Así, es necesario evaluar a ambas para establecer si un proceso definitivamente es o no espontáneo en ciertas condiciones.
La energía libre de Gibbs es: la energía liberada por un sistema para realizar trabajo útil a presión constante. Ésta se representa con el símbolo G y considera ambos cambios de tal forma que:
∆G = ∆H – T∆S
La variación de la energía libre ∆G, es una función de estado y tiene unidades de energía. Así, si en una reacción química se libera trabajo útil sin importar lo que ocurra en el universo el ∆G es negativo y por lo tanto será una reacción espontánea, puesto que considera la dispersión de la energía ∆H = - y la dispersión de la materia ∆S = + en el sistema.
De esta manera, si una reacción ocurre a bajas temperaturas con un cambio pequeño de entropía, entonces el término TDS será insignificante y DG dependerá principalmente de DH.
Las reacciones endotérmicas ocurren solamente si TDS es grande. La temperatura tiene que ser alta o tiene que haber aumento grande en la entropía para que predomine este término y sea el que determine el valor del ∆G.
Si:
∆G < 0 La reacción es espontánea en el sentido establecido.
∆G > 0 La reacción no es espontánea en el sentido establecido.
∆G = 0 El sistema está en equilibrio.
La energía estándar de reacción, es el cambio de la energía estándar de productos menos el cambio de la energía estándar de reactivos
∆G0 reacción = ∑n ∆G0 productos – ∑n ∆G0 reactivos
Se considera para los elementos en su forma más estable en condiciones estándares ∆G0 = 0.
 Calcular la variación de la energía libre a 25 0C y 1 atmósfera de presión para la siguiente reacción y establecer si es o no espontánea.
Calcular la variación de la energía libre a 25 0C y 1 atmósfera de presión para la siguiente reacción y establecer si es o no espontánea.
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
∆G0 = -32.89 kJ/mol + ∆G0 = 0 ∆G0 = -394.4 kJ/mol + ∆G0 = -237.2 kJ/mol

∆G0 reacción = ∑n ∆G0 productos – ∑n ∆G0 reactivos
∆G0 reacción = -868.8 kJ – (-32.89 kJ)
∆G0 reacción = -835.91 kJ
∆G0 reacción < 0 Reacción espontánea
Si la reacción se lleva a cabo a otra temperatura, es necesario hacer una corrección y se utiliza:
∆G0 reacción = ∆H0 reacción – T∆S0 reacción
Si la reacción se realiza a 400 K, se calcula:
∆H0 reacción = -890.4 kJ
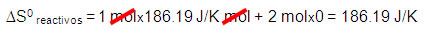
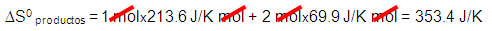
∆S0 reacción = 353.4 J/K – 186.19 J/K =167.21 J/K
Nota: El valor de S0 por ser pequeño está reportado en J/K mol
∆G0 reacción = ∆H0 reacción – T∆S0 reacción

∆G0 reacción = -957.28 Reacción espontánea
 Actividad
Actividad
Ve a la dirección http://www.educaplus.org/_oa/energia_libre_gibbs.swf donde podrás modificar las variables que determinan el cambio de la energía libre.
 Calcular la variación de la energía libre de Gibbs para las reacciones siguientes a 250C y 2000C y decir si son o no espontáneas a estas temperaturas:
Calcular la variación de la energía libre de Gibbs para las reacciones siguientes a 250C y 2000C y decir si son o no espontáneas a estas temperaturas:
a) CO2(g) + H2O(l) → C6H12O6(s) + O2(g)
b) C2H2(g) + 2 1/2O2(g) → 2CO2(g) + H2O(l)
c) 2H2O(l) → 2H2(g) + O2(g)
Anterior Subtema 1.1 Siguiente



