Un sistema en equilibrio puede ser alterado si se modifican las condiciones que se establecieron para lograr el equilibrio. Esto es, puede haber cambios en las concentraciones de los reactivos y/o productos, la presión, el volumen y la temperatura del sistema y romper el equilibrio.
Estos cambios en los sistemas en equilibrio fueron estudiados por el Químico Industrial Henri Louis Le Chatelier, quien estableció: si un sistema en equilibrio es perturbado por un cambio de temperatura, presión o concentración, el sistema se desplazará en la dirección que contrarreste al mínimo dicha perturbación, lográndose un nuevo estado de equilibrio.
-
Cambios de concentración. Cuando se agrega una sustancia a un sistema en equilibrio, reactivo o producto, éste se desplazará en el sentido que lo contrarreste consumiendo la sustancia adicionada y conseguir un nuevo estado de equilibrio.
Si por el contrario, se extrae del sistema reactivo o producto, el sistema se dirigirá en la dirección que se forme más de la sustancia retirada.
 En la reacción:
En la reacción:
2NO(g) + O2(g)  2NO2(g)
2NO2(g)
a) Si se agrega NO y/o O2 o ambos, la reacción se desplaza en el sentido que se consuman, hacia la formación de NO2.
b) Se adiciona NO2, la reacción se desplaza hacia la formación de reactivos.
c) Si se retira NO y/o O2 o ambos, el sentido de la reacción que se favorece es hacia la formación de la sustancia o sustancias retiradas, hacia la izquierda.
d) Se extrae NO2, la reacción se orienta a la formación de éste, hacia la derecha.
-
Cambios en el volumen y la presión. Un sistema en equilibrio a temperatura constante en el que se reduce el volumen origina un aumento en la presión total, de tal forma que el equilibrio se desplazará en el sentido que disminuya la presión ejercida por las moléculas, es decir, donde haya menor número de moles gaseosos. Los cambios de presión no afectan a los líquidos ni a los sólidos por ser prácticamente incompresibles.
Si se produce el cambio contrario, un aumento en el volumen, la presión disminuye, entonces la reacción se desplaza hacia donde exista mayor número de moles gaseosos. En un sistema con igual número de moles gas en reactivos y productos, un cambio de presión no afecta la posición del equilibrio.
 Para la reacción anterior:
Para la reacción anterior:
a) Un aumento en la presión, reduce el volumen y por consiguiente el número total de moles gas por unidad de volumen es mayor. Para contrarrestar este aumento de concentración se orienta hacia la disminución del número de moles, a la producción de NO2.
b) Disminuir la presión en este sistema aumenta el volumen y se favorece la formación de reactivos, hacia el aumento en el número de moles gas.
-
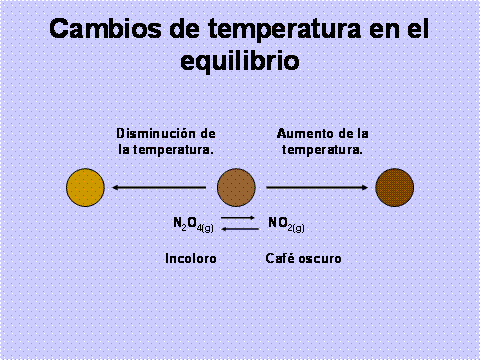
Cambios en la temperatura. Los cambios de concentración, presión y volumen sólo alteran la posición del equilibrio y no el valor de la constante de equilibrio como sucede con los cambios de temperatura. Hay que recordar que para cada temperatura la Keq tiene un determinado valor.
Para saber cómo afecta la temperatura a un sistema en equilibrio, es necesario tomar en cuenta los cambios de entalpía. Una reacción endotérmica requiere energía para llevarse a cabo, por lo que se puede considerar como un reactivo, un incremento en la temperatura es como si se adicionara dicho reactivo, por lo tanto, el sistema se desplaza hacia los productos.
Una reacción reversible, si en un sentido es endotérmica en el sentido contrario es exotérmica con un cambio de entalpía exactamente igual pero con signo contrario. Así, un aumento en la temperatura beneficia a la reacción endotérmica, mientras que la reacción exotérmica se favorece con la disminución.
 Actividad
Actividad
Ve a la siguiente dirección donde encontrarás una presentación que te servirá de apoyo en la comprensión del principio de Le Chatelier:
http://www.mhhe.com/physsci/chemistry/essentialchemistry/flash/lechv17.swf
 Analiza los siguientes sistemas en equilibrio y determina en qué sentido se desplazará cada una de las reacciones cuando:
Analiza los siguientes sistemas en equilibrio y determina en qué sentido se desplazará cada una de las reacciones cuando:
a) Se extraiga parte de los reactivos.
b) Aumente la concentración de uno de reactivos.
c) Aumente la presión.
d) Aumente el volumen.
c) Si incremente la temperatura.
1. PCl5(g)  PCl3(g) + Cl2(g) → endotérmica
PCl3(g) + Cl2(g) → endotérmica
2. H2(g) + CO2(g)  H2O(g) + CO(g) → endotérmica
H2O(g) + CO(g) → endotérmica
3. N2(g) + 3H2(g)  2NH3(g) → exotérmica
2NH3(g) → exotérmica
Anterior Subtema 2.2 Siguiente






 Analiza los siguientes sistemas en equilibrio y determina en qué sentido se desplazará cada una de las reacciones cuando:
Analiza los siguientes sistemas en equilibrio y determina en qué sentido se desplazará cada una de las reacciones cuando: