Para comprender desde el punto de vista submicroscópico, cómo es que una reacción se lleva a cabo, es importante basarse en lo que se conoce como, Teoría de las colisiones. En ella se consideran a las partículas, ya sean átomos, moléculas o iones, como pequeñas esferas sólidas moviéndose de manera totalmente aleatoria. En esta teoría se contempla cumplir con tres condiciones para considerar que las reacciones puedan ocurrir:
-
Las moléculas, átomos o iones de los reactivos deben chocar entre sí.
-
Los choques entre las moléculas, átomos o iones deben de ser con suficiente energía.
-
Para que exista un reordenamiento en los átomos de las moléculas, átomos o iones de los reactivos, estos deben chocar con una orientación determinada (orientación correcta), para así formar el “complejo activado”, consecuencia de lo que se conoce como el “estado de transición”, que es un paso previo a la obtención de los productos.
Estas condiciones se pueden explicar en el siguiente ejemplo, en donde se analiza la posible reacción entre el hidrógeno (H2) y el Yodo (I2), ambas sustancias en estado gaseoso:
H2 (g) + I2 (g) â 2HI (g)
En primer lugar las moléculas de ambas sustancias chocan entre sí, pero deben hacerlo de manera efectiva, es decir con la suficiente energía y orientación correcta para que la reacción pueda ocurrir.
Obsérvese en la siguiente figura, en los casos (a), (b) y (c) el choque entre el hidrógeno y el yodo no es efectivo, consecuentemente no se obtuvo yoduro de hidrógeno (producto de la reacción química). En el caso (d) sucedió lo contrario ya que el choque fue efectivo y por lo tanto si hubo reacción. El modelo de esferas que representan un choque eficaz, también representan el “estado de transición” donde se forma el complejo activado, que finalmente da lugar al reordenamiento de los átomos, es decir la aparición de los productos.
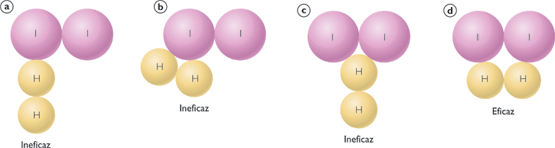
Figura 1. Representación de las colisiones efectivas y no efectivas en la reacción química entre el hidrógeno y el yodo. (Tomada de: www.colegioheidelberg.com/deps/fisicaquimica/...)
 Actividad
Actividad
Para visualizar y comprender que pasa a nivel microscópico, descarga la presentación de la siguiente dirección, te mostrará que para que los reactivos se transformen en productos, se necesita que haya colisiones entre partículas dadas en la dirección correcta.
http://www.mhhe.com/physsci/chemistry/essentialchemistry/flash/collis11.swf
(Tomada para fines educativos de Aula Física y Química)
Anterior Subtema 2.1 Siguiente


 Actividad
Actividad