Algunos tipos de átomos tienden a unirse químicamente con otros átomos, iguales o diferentes, para formar moléculas y adquirir estados más estables de energía.
La unión se da a través de enlaces covalentes que dan como resultado moléculas diatómicas o poliatómicas energéticamente más estables que los átomos individuales.
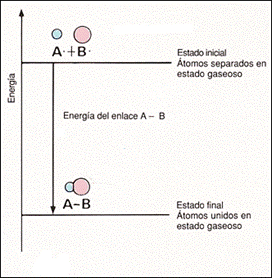
A la medida de dicha estabilidad se le denomina energía de enlace y es la que corresponde al cambio de entalpía necesario para romper un enlace específico de un mol de moléculas gaseosas. Cuando se forma un mol del mismo tipo de moléculas a partir de átomos gaseosos, la magnitud de la entalpía es igual, pero de signo contrario, esto es, se libera energía.
La energía de enlace se determina experimentalmente a presión atmosférica (1 atmósfera), temperatura de 25 oC (298.15 K) y en fase gaseosa por la menor influencia de las interacciones moleculares.
A las mediciones realizadas a esta presión y temperatura se les llama condiciones estándares.
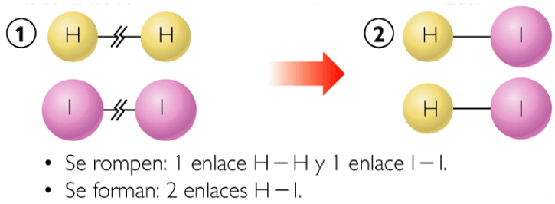
 La entalpía de enlace medida experimentalmente para un mol de moléculas de hidrógeno y ácido clorhídrico es:
La entalpía de enlace medida experimentalmente para un mol de moléculas de hidrógeno y ácido clorhídrico es:
H2(g) → H(g) + H(g) ∆H = 436.4 kJ
HIl(g) → H2(g) + Il2(g) ∆H = 298.3 kJ
Imágenes tomadas de:
http://www.kalipedia.com/fisica-quimica/tema/reacciones-quimicas/energia-calor-reaccion.html?x=20070924klpcnafyq_120.Kes&ap=0
La determinación de la energía de enlace para las moléculas diatómicas con átomos iguales o diferentes y con enlaces simples, dobles o triples, se calcula directamente, pero en las moléculas poliatómicas resulta más complicado, puesto que interviene la influencia de los otros enlaces presentes en la molécula ya sean iguales o diferentes, en otras palabras, de las condiciones químicas que prevalezcan.
En moléculas poliatómicas sólo se puede hablar de energía de enlace promedio para un tipo de enlace.
En la siguiente tabla encontrarás los valores de las entalpías de enlace más utilizadas:
TABLA DE ENTALPÍAS DE ENLACE
ENLACE |
Entalpía de enlace
kJ/ mol de enlaces |
ENLACES |
Entalpía de enlace
kJ/ mol de enlaces |
C - H |
413 |
H - H |
436 |
O - H |
482 |
C - O |
743 |
N - H |
391 |
C = C |
835 |
O = O |
494 |
H - F |
563 |
C - C |
348 |
H - Cl |
432 |
C = C |
612 |
C - F |
485 |
C - N |
292 |
C - Cl |
339 |
C = O (en CO2) |
801 |
F - F |
153 |
C - O |
351 |
Cl - Cl |
243 |
La energía de enlace es útil para predecir la entalpía aproximada de una reacción, considerando que para la ruptura de enlaces químicos siempre se tiene que suministrar energía y para la formación de nuevos enlaces se libera. Así, la entalpía de una reacción se puede calcular a partir del número de enlaces que se rompen y se forman.
∆Hr = ∑∆H(reactivos) - ∑∆H(productos)
 Calcular la variación de la entalpía de reacción cuando se forma amoniaco a partir de nitrógeno e hidrógeno.
Calcular la variación de la entalpía de reacción cuando se forma amoniaco a partir de nitrógeno e hidrógeno.
N2(g) + 3H2(g) → 2NH3(g)
Representación microscópica de la reacción
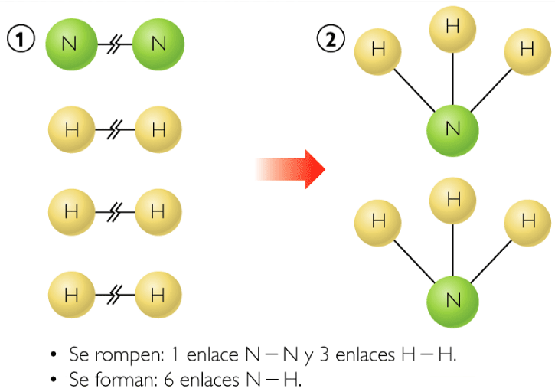
Imagen tomada de:
http://www.kalipedia.com/fisica-quimica/tema/reacciones-quimicas/energia-calor-reaccion.html?x=20070924klpcnafyq_120.Kes&ap=0
Inicialmente para romper los enlaces de los reactivos, la energía requerida es:
Número de enlaces rotos en un mol de moléculas x entalpía de enlace
1 enlace N≡N x 991 kJ = 991 kJ
3 enlaces H-H x 436 kJ = 1308 kJ
∑∆H(reactivos) = 2299 kJ
Al formarse los enlaces N-H en el amoniaco, se libera:
Número de enlaces formados en un mol de moléculas x entalpía de enlace
6 enlaces N-H x 391 kJ = 2346 kJ
∑∆H(productos) = 2346 kJ
∆Hr = ∑∆H(reactivos) - ∑∆H(productos)
∆Hr =+ 2299 kJ – 2346 kJ
∆Hr = - 47 kJ Reacción exotérmica
Nota: A un lado poner ∆H > 0 Reacción exotérmica
∆H < 0 Reacción endotérmica
Este resultado nos dice que, cuando se forman dos moles de moléculas de amoniaco a partir de un mol de moléculas de nitrógeno y tres moles de hidrógeno, se liberan 47 kJ de energía.
Tener presente, que el signo positivo indica que se suministra energía a la reacción y el signo negativo, que se libera energía cuando se lleva a cabo la reacción.
 En la combustión del metano se obtiene dióxido de carbono y agua de acuerdo a la siguiente reacción:
En la combustión del metano se obtiene dióxido de carbono y agua de acuerdo a la siguiente reacción:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
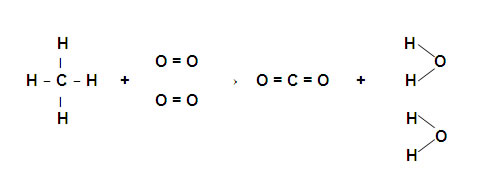
Se rompen: 4 enlaces C-H y 2 enlaces O=O
Se forman: 2 enlaces C=O y 4 enlaces H-O
Número de enlaces rotos en un mol de moléculas x entalpía de enlace
4 enlaces C-H x 413 kJ = 1652 kJ
2 enlaces O=O x 494 = 988 kJ
∑∆H(reactivos) = 2640 kJ
Al formarse los enlaces C=O en el dióxido de carbono y H-O en el agua, se libera:
Número de enlaces formados en un mol x entalpía de enlace
2 enlaces C=O x 801 kJ = 1602 kJ
4 enlaces H-O x 482 kJ = 1928 kJ
∑∆H(productos) = 3530 kJ
∆Hr = ∑∆H(reactivos) - ∑∆H(productos)
∆Hr = + 2640 kJ – 3530 kJ
∆Hr = - 890 kJ Reacción exotérmica
Esta ecuación termoquímica nos dice que cuando se quema un mol de moléculas de metano con dos moles de moléculas de oxígeno, se obtiene un mol de moléculas de dióxido de carbono, dos moles de moléculas de agua y 890 kJ de energía.
Las reacciones de combustión de hidrocarburos desempeñan un papel muy importante en nuestro estilo de vida actual. Debido a la gran cantidad de energía que obtenemos de ellas podemos manejar un automóvil, cocinar los alimentos, encender la calefacción, tomar una ducha tibia y tener a nuestro alcance una enorme diversidad de productos industriales de uso cotidiano.
Los seres vivos necesitamos energía y la obtenemos de la combustión de los alimentos, reacciones exotérmicas que liberan cierta cantidad de energía dependiendo de su composición química. Los humanos empleamos gran parte de esa energía en mantener nuestra temperatura corporal.
En los procesos físicos de cambio de fase, también existen cambios de entalpía. Estos procesos son reversibles, de tal manera que la cantidad de energía necesaria suministrada para pasar de sólido a líquido o de líquido a gas, es exactamente la misma que se libera cuando se verifican los procesos contrarios.
Procesos endotérmicos: condensación y solidificación.
Procesos exotérmicos: fusión y evaporación.
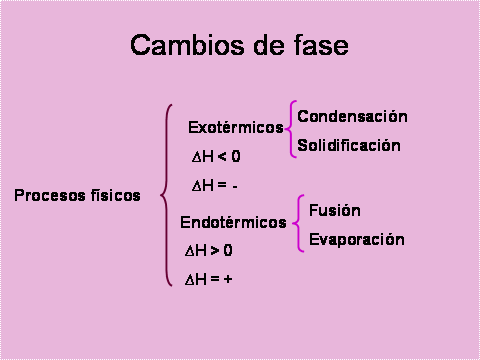
 Para lograr que un mol de agua en fase sólida (hielo), a 1 atmósfera de presión, pase completamente a fase líquida (fusión), el sistema debe absorber 6.01 kJ de energía. Es un proceso endotérmico en el que el ∆H = +6.01 kj.
Para lograr que un mol de agua en fase sólida (hielo), a 1 atmósfera de presión, pase completamente a fase líquida (fusión), el sistema debe absorber 6.01 kJ de energía. Es un proceso endotérmico en el que el ∆H = +6.01 kj.
Si lleva a cabo el proceso contrario, la solidificación, el proceso es exotérmico y el sistema desprende 6.01 kJ, ∆H = -6.01 kJ.
 Calcular la energía de enlace de las siguientes reacciones y establecer con base en los resultados, si es exotérmica o endotérmica.
Calcular la energía de enlace de las siguientes reacciones y establecer con base en los resultados, si es exotérmica o endotérmica.
2H2O(l) → 2H2(g) + O2(g)
C2H6 + 3 1/2O2(g) → 2CO2(g) + 3H2O(g)
Anterior Subtema 1.1 Siguiente









