La materia la definimos como todo lo que ocupa un lugar en el espacio y tiene masa y el concepto se apega a su descripción.
La energía como la capacidad para realizar un trabajo, pero desde el punto de vista macroscópico no siempre es cierto, de esta manera no es un concepto muy exacto para describirla, pero se reconoce por sus efectos. Así, otro concepto que utilizan los químicos relacionado con el enfoque de su interés es, el cambio de energía producida por un proceso. Para el objetivo de nuestro estudio diremos que energía es todo aquello capaz de producir un cambio
La termodinámica es la ciencia que estudia las transformaciones de la energía. Teóricamente cualquier tipo de energía se puede transformar en otro tipo íntegramente, lo que nos conduce a la ley de la conservación de la energía: la energía no se crea ni se destruye, sólo se transforma; en otras palabras, la energía total del universo permanece constante
. Actividad
Actividad
Para que comprendas mejor este tema, consulta de la siguiente página inglés, la introducción y qué es la energía. Te va a ayudar a adquirir habilidad en la comprensión de textos en este idioma.
http://www.energyquest.ca.gov/story/index.html (Tomada para fines didácticos).
Para reafirmar lo que leíste en la página anterior, ahora lee el capítulo y realiza las evaluaciones contenidas en “La Energía (3o ESO)” de la siguiente página:
http://www.quimicaweb.net/ (Tomada para fines didácticos).
Reporta tus comentarios y el resultado de tus evaluaciones a tu tutor, si tienes dudas te ayudará a resolverlas.
Como sabemos, la energía está presente en procesos físicos y químicos, pero nuestro interés principal está dirigido a los cambios energéticos en las reacciones químicas.
La termoquímica, es una rama de la termodinámica que estudia los cambios de energía cuando se verifica una reacción química, principalmente en forma de energía térmica que se involucra en los procesos de calor.
La palabra calor estamos acostumbrados a usarla para referirnos a caliente o frío, pero el calor es el proceso de energía térmica que se transfiere de un sistema a otro debido a una diferencia de temperatura. Esto quiere decir, que la transferencia de la energía térmica siempre ocurre si hay diferencia de temperaturas entre dos sistemas y la dirección siempre será del de mayor temperatura al de menor hasta lograr un equilibrio térmico o igualar su temperatura.
La Ley Cero de la Termodinámica nos dice: Cuando dos sistemas están en equilibrio térmico con un tercer sistema, también lo estarán entre sí.
 Si un sistema A está en equilibrio térmico con un sistema C y un sistema B está en equilibrio térmico con el sistema C, entones los sistemas A y B, también están en equilibrio térmico.
Si un sistema A está en equilibrio térmico con un sistema C y un sistema B está en equilibrio térmico con el sistema C, entones los sistemas A y B, también están en equilibrio térmico.
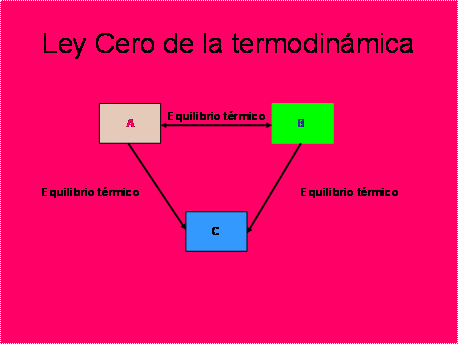
Debe quedar claro que el calor no es energía, es un proceso de transferencia de energía térmica entre dos sistemas que se encuentran a diferente temperatura.
Otra definición que se maneja:
Calor es la energía interna que sale de un sistema y entra a otro si se encuentran a diferente temperatura.
Hablaremos de la energía interna más adelante.
EL TÉRMINO CALOR implica “transferencia de energía” y la mayoría de la bibliografía lo utiliza para describir los cambios de energía que ocurren durante un proceso. Así, es común que se maneje como “calor absorbido” o “calor liberado”, o simplemente para cualquier proceso en el que esté implicada la energía térmica. (Chang, 2002).
Para poder analizar los cambios de energía asociados a las reacciones químicas, debemos delimitar nuestro objeto de estudio, que es a lo que vamos a llamar sistema.
 Actividad
Actividad
Abre el siguiente documento y contesta brevemente lo que se te pide en tu cuaderno.
Sistemas.ppt
Un sistema es una parte del universo que nos interesa estudiar, delimitada por una frontera real o imaginaria y lo que se encuentra fuera de ésta son los alrededores o entorno.
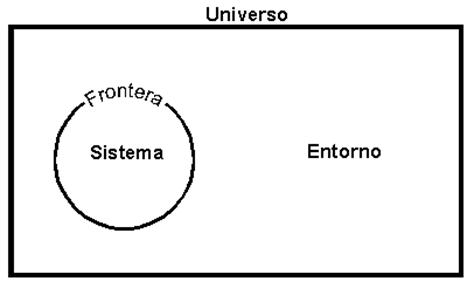
Los sistemas pueden clasificarse de acuerdo al tipo de frontera o paredes que tengan en:
-
Abiertos.
-
Cerrados.
-
Aislados.
Las paredes pueden ser:
-
Adiabáticas: No permiten el intercambio de energía térmica.
-
Diatérmicas: Sí permiten el intercambio de energía térmica.
-
Rígidas. No permiten variación de volumen.
-
Flexibles. Sí permiten variación de volumen.
-
Impermeables. No permiten el paso de masa.
-
Permeables. Si permiten el paso de masa.
-
Semipermeables. Permiten selectivamente el paso de masa.
Sistemas abiertos son aquellos en los que hay intercambio de materia y energía con los alrededores o el entorno, debido a paredes permeables y diatérmicas. Por ejemplo, una olla con agua hirviendo.
Sistemas cerrados son aquellos en los que hay intercambio de energía pero no de materia con los alrededores o el entorno, debido a paredes impermeables y diatérmicas, por ejemplo, un tanque de gas cerrado.
Sistemas aislados son aquellos en los que no hay intercambio de materia ni de energía con los alrededores o el entorno, debido a paredes impermeables y adiabáticas. El universo es un ejemplo de sistema aislado en donde la materia y la energía se conservan. Los sistemas aislados son escasos y los que ha creado el hombre son imperfectos, como por ejemplo, “los termos” para el agua o el café.

 Actividad
Actividad
Contesta nuevamente las preguntas que se hacen en la presentación y compáralas con tus respuestas y entrégaselo a tu profesor para que las revise y te aclare las dudas que tengas.
Estados
Propiedades de los sistemas:
Los sistemas se caracterizan por tener una serie de propiedades. Estas se clasifican en:
-
Propiedades Extensivas: Son aquellas propiedades que dependen de la masa total del sistema, como el volumen y cantidad de sustancia.
-
Propiedades Intensivas: Son aquellas propiedades que no dependen de la masa total sistema, son uniformes y se pueden medir en cualquier parte, como la temperatura y la presión.
El estado de un sistema termodinámico queda definido cuando cada una de sus propiedades tiene un valor determinado como la temperatura, la presión y el número de moles en los gases. Si éstas cambian de un valor inicial a uno final, se le llama cambio de estado. Cuando se lleva a cabo un cambio de estado por algún método de operación, se le conoce como proceso. En termodinámica al hablar de estado, NO NOS referimos a un estado de agregación.
 Si se tiene un sistema que contiene 1g de agua a 25 oC y 1 atm de presión, ocupará un volumen aproximado de 1 mL. Estas cantidades especifican el estado del sistema y siempre que se cumplan las cuatro condiciones, se tendrá agua en el mismo estado y la cantidad total de energía en las moléculas, también será la misma. Cuando cambia alguna de las propiedades del sistema se pondrá de manifiesto un cambio de estado.
Si se tiene un sistema que contiene 1g de agua a 25 oC y 1 atm de presión, ocupará un volumen aproximado de 1 mL. Estas cantidades especifican el estado del sistema y siempre que se cumplan las cuatro condiciones, se tendrá agua en el mismo estado y la cantidad total de energía en las moléculas, también será la misma. Cuando cambia alguna de las propiedades del sistema se pondrá de manifiesto un cambio de estado.
La trayectoria o camino es la secuencia de pasos intermedios que se llevan a cabo para lograr un cambio de estado.
Así, si un proceso se lleva a cabo a presión constante se dice que es isobárico, a volumen constante isocórico, a temperatura constante isotérmico y si el sistema está aislado, adiabático.
Se conocen como funciones de estado a aquellas que sólo dependen del estado inicial y final, no de la trayectoria que siguieron para el cambio, tal es el caso de la temperatura, presión, volumen, entalpía, entropía y energía libre; por lo que se representan como gradientes o diferencias (∆P = pf – pi). El calor y el trabajo no son funciones de estado.
 Si se quiere elevar la temperatura de los siguientes sistemas desde un estado inicial a uno final, no importa el proceso por el que se consiga.
Si se quiere elevar la temperatura de los siguientes sistemas desde un estado inicial a uno final, no importa el proceso por el que se consiga.
Puede ser a través de una fuente de energía térmica (a), por trabajo mecánico (b) o por trabajo eléctrico (c). La temperatura por lo tanto es una función de estado.
∆T = tf – ti
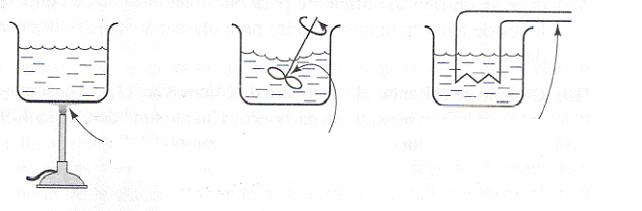
a b c
Una analogía es: si se quiere llegar de la Preparatoria 8 a Ciudad Universitaria, no importa la ruta que se siga, sólo importa el punto inicial y final.

Función de trayectoria, aquella que depende de los pasos seguidos en el proceso, como el calor y el trabajo.
Como ya hemos mencionado, el calor es un proceso de transferencia de energía térmica de un sistema a otro de manera espontánea, el que se representa:
q = mCp∆T
q = cantidad de energía transferida en Joules o calorías.
m = cantidad de masa en kg o g.
Cp = capacidad térmica específica a presión constante en J/g oC, kJ/ kg oC o cal/g oC.
∆T = gradiente o diferencia de temperaturas (tf – ti), en grados Celsius.
La capacidad térmica específica, calor específico o , es la cantidad de energía térmica necesaria para elevar la temperatura de una sustancia en 1ºC. Cada sustancia tiene diferente capacidad térmica específica o calor específico. Es una propiedad particular de cada sustancia.
Sustancia |
Capacidad térmica específica o Calor específico medio en J/g oC a 25 0C |
Agua |
4.18 |
Hielo |
2.34 |
Aluminio |
0.90 |
Hierro |
0.113 |
Cobre |
0. 47 |
Plomo |
0.0 3 1 |
Plata |
0.13 |
Mercurio |
0.13 |
El trabajo es la cantidad de energía que se requiere para empujar un objeto y lograr un desplazamiento o elevarlo contra la fuerza de gravedad
w = f x d o w = mg∆h
w = trabajo en J o kJ m = masa en kg.
f = fuerza en kg m/s2 = N o g = 9.81 m/s2
d = distancia desplazada en m. ∆h = gradiente o diferencia de alturas
(hf – hi), en m.
Todos los sistemas tienen energía y hacen trabajo o transfieren energía térmica para intercambiarlos con otros sistemas.
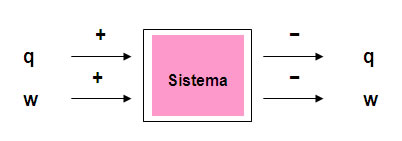
Por convención, para indicar si el calor o el trabajo se hacen sobre el sistema o si el sistema los hace hacia el entorno o alrededores, se tiene:
Entra energía mecánica o eléctrica al sistema signo positivo
Sale del sistema energía mecánica o eléctrica signo negativo
Entra energía térmica al sistema signo positivo
Sale del sistema energía térmica signo negativo
 Si se quiere elevar la temperatura a 40oC de 200 mL de agua contenida en una taza, para prepara café. ¿Qué cantidad de energía térmica hay que suministrarle si se encuentra inicialmente a una temperatura de 20oC? Considera la densidad del agua de 1 g/mL.
Si se quiere elevar la temperatura a 40oC de 200 mL de agua contenida en una taza, para prepara café. ¿Qué cantidad de energía térmica hay que suministrarle si se encuentra inicialmente a una temperatura de 20oC? Considera la densidad del agua de 1 g/mL.
Nuestro sistema es el agua; las paredes internas de la taza, son la frontera o la pared y el medio ambiente es el alrededor o entorno. Como la densidad del agua es 1 g/mL, la cantidad de g es igual a al cantidad de mL.
m = 200 g
Cp = 4.18 j/g oC = 1 cal/g oC
ti = 20 oC
tf = 40 oC
q = mCp∆T
q = 200 g x 4.18 J/goC x (40 – 20) oC
q = 16720 J = 4000 cal
La energía entra al sistema q = +16720 J = +4000 cal
En el caso contrario, que se quiera bajar la temperatura del agua por algún proceso, de 40 oC a 20 oC, el sistema tendrá que desprender la misma cantidad de energía por medio de trabajo o calor pero ahora el signo será negativo puesto que sale del sistema (-16720 J = -4000 cal).
Si se quiere realizar este mismo proceso con aluminio, se tiene:
q = mCp∆T
q = 200 g x 0.90 J/goC x (40 – 20) oC
q = +3600 J = +861.24 cal
Esto muestra que la cantidad de energía es 4.6 menor que la requerida para elevar la temperatura de la misma cantidad de agua. Los metales aumentan su temperatura más rápidamente con menor cantidad de energía que otros materiales, como el agua y los aislantes térmicos.
Ahora se quiere subir un borrego con una masa de 200 kg, por medio de una polea desde el piso hasta una segunda planta que se encuentra a 5 m de altura. ¿Qué cantidad de energía se requiere para efectuar este trabajo?
Nuestro sistema es el borrego; la frontera o la pared, es lo que delimita a todo el borrego y el alrededor o entorno es el medio ambiente.
m = 200 kg
g = 9. 81 m/s2
hi = 0 m
hf = 5 m
En este caso usaremos:
w = mg∆h
w = 200 kg x 9.81 m/s2 x (5 - 0) m
w = 9810 kg m2/s2 = 9810 J
Se hace trabajo sobre el sistema w = +9810 kg m2/s2 = +9810 J
Anterior Subtema 1.1 Siguiente

 Actividad
Actividad

 Actividad
Actividad

 Actividad
Actividad




